心肌梗死和外周动脉疾病的核心病理特征是动脉闭塞而引起的组织缺血,进而可导致患者残疾或死亡。但目前尚缺乏能够有效促进血管新生的小分子化合物。近日,中国科学院遗传与发育生物学研究所王秀杰研究员团队与复旦大学孟丹教授团队合作,鉴定出一种通过靶向抑制转录因子BACH1 (BTB and CNC homolog 1) 而促进血管再生的小分子化合物BI003,为缺血性心血管疾病患者的血管新生和病理改善提供一种靶向明确、廉价高效的新选择。相关成果以“A BACH1 Inhibitor Ameliorates Myocardial Infarction and Limb Ischemia in Mice”为题在Molecular Therapy上在线发表。
转录因子BACH1(BTB and CNC homology 1)是碱性亮氨酸拉链蛋白(bZIP)家族的成员,能通过抑制Wnt/β-catenin信号通路来抑制血管新生。孟丹教授团队的前期研究结果发现,抑制BACH1可能成为治疗缺血性心血管疾病的全新途径。但由于缺乏直接作用于BACH1的小分子抑制剂,常用的通过BACH1上游因子而调控BACH1表达的方法存在较大副作用风险。
王秀杰研究组的刘鑫副研究员基于BACH1蛋白的三维结构进行小分子化合物虚拟筛选,鉴定出一种可直接作用于BACH1的新型小分子抑制剂BI033。BI033能够特异性地锚定于BACH1蛋白中BTB结构域的第91位丙氨酸位点,通过抑制BACH1蛋白的转录活性而促进BACH1下游抗氧化应激基因HMOX1和血管内皮生长因子VEGFA等血管新生相关基因的表达。进一步的机制研究表明,BI033既能减少BACH1在促血管新生相关基因启动子区域的结合,又能够促进与BACH1存在竞争性结合关系的转录因子NRF2的表达及其在促血管新生相关基因启动子区域的结合,从而促进血管新生。平行比较的结果显示,BI033促进VEFGA表达的能力显著优于NRF2的激活剂。此外,BI033还可以抑制BACH1与组蛋白去乙酰化酶HDAC1的结合,从而提升BACH1下游靶基因的H3K27ac修饰水平,进一步促进促血管新生相关基因的转录。
动物实验表明,BI033处理能显著改善心肌梗死模型小鼠的左心室射血分数,减少梗死区的瘢痕面积,增加梗死边界区的血管密度。在小鼠下肢缺血模型中,BI033处理也显著增强了缺血下肢的血流灌注,增加了缺血组织边界区的血管密度。由于在设计之初就尽量降低小分子在细胞膜穿透性、药物代谢特性、药物致毒性等方面的风险因素,BI033在人脐静脉内皮细胞中表现出比阳性对照分子更低的细胞毒性,在小鼠体内的急毒测试中也未见任何不良反应或负面效果。
综上,该研究发现了一种通过抑制BACH1而促进血管新生和减轻缺血性损伤的小分子化合物BI033,为心肌梗死和外周缺血性疾病的治疗提供了新的策略,具有良好的临床转化潜力。
复旦大学基础医学院博士研究生林佳怡、李沁函和中国科学院遗传与发育生物学研究所副研究员刘鑫为该文章的共同第一作者,复旦大学基础医学院孟丹教授、郭阶雨博士后和中国科学院遗传与发育生物学研究所王秀杰研究员为文章的共同通讯作者。研究还获得了奥地利格拉茨医科大学Elena Osto教授团队的大力支持。该研究得到国家自然科学基金重大研究计划重点项目、上海市优秀学术带头人项目、国家重点研发计划项目和中国博士后基金等项目的资助。
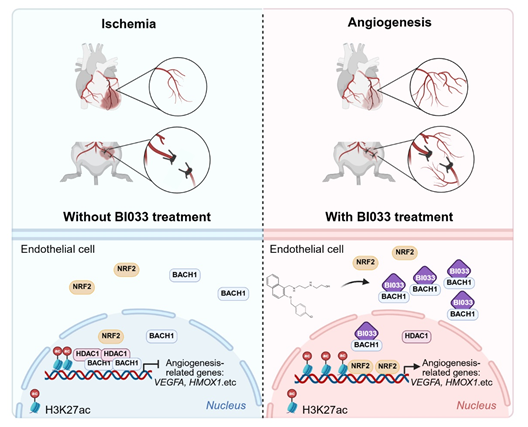
图:BI033通过抑制BACH1而促进血管新生的机制
原文链接:https://www.cell.com/molecular-therapy-family/molecular-therapy/abstract/S1525-0016(25)00544-1
来源:中国科学院遗传与发育生物学研究所


 会员注册
会员注册 会员登录
会员登录